Moderne fjørfe produksjon involverer produksjon av store mengder dyr på oppbygget strø i høy tetthet. Et norsk kyllinghus inneholder til en hver tid alt ifra 5000-30000 kyllinger som blir alet opp i en tetthet på maks 36 kg per kvadratmeter.
Produksjonen er basert på «alt inn-alt ut» prinsippet, fuglene ankommer ved klekking, er i huset under oppalings perioden, deretter hentet ut og slaktet. Etter noen uker setter man inn på ny. I Norge er det vanlig at man fjerner strø mellom innsettene og vasker og desinfiserer huset. I USA er det vanlig at man avler opp til 6 flokker på det samme strøet før man skifter, det vil si at at flere flokker representer en populasjon (Chapman, 2014). Denne produksjonsstrategien har mye å si for hvordan man velger å bekjempe parasitter og bakterier. Når man driver en intensiv produksjon i strø lager man et ideelt miljø for overførsel av parasitter, særlig parasitter som Eimeria (koksidie) som utvikler seg i tarmen og har en oral/fecal livssyklus (Chapman, 2014). Om man ikke forsøker å kontrollere denne parasitten, gjennom vaksine eller medisinering vil den oppformere seg i så stor grad at kyllingen kan få koksidiose. Det er sjeldent med kliniske utbrudd, men sub-kliniske utbrudd er vanlig og fører til redusert tilvekst og økt fôrforbruk som igjen rammer økonomien til bonden.

Ettersom man har fjernet den mest effektive beskyttelsen mot koksidiose fra fôret må man sette sin lit til andre metoder. Vaksinasjon ble raskt et alternativ da vaksinasjonsmetoden er godt utprøvd i de fleste andre land der det drives kyllingproduksjon. De fleste tilgjengelige vaksinene inneholder svekkede eller ikke svekkede stammer av koksidier. Disse kan administreres gjennom drikkevannet eller sprayes på fôret på gården, nyere metoder inkluderer å bruke spraykabinetter på klekkeriet. Spraykabinnetter på klekkeriet blir brukt i Norge, da de blir sett på som den mest effektive metoden. Hvilken metode som fungerer best i praksis - gir best beskyttelse for dyrene - kan man ikke si så mye om, da det etter min oppfatning ikke er blitt skikkelig utprøvd eller testet i norsk produksjon. Når det er sagt så har tester fra utlandet vist at kylling som har inntatt så få som 10 oocyster kan resultere i opptil 500000 oocyst avkom. Selv om spray vaksiner på klekkeriet ikke sørger for at hvert enkelt individ inntar oocyster, er det sannsynlig at fuglene får det i seg gjennom stell av fjærdrakt, eller at det inntas gjennom tårekanalen og inn i nesehulen hvor oocysten da fortsetter sin ferd ned mot tarmen. Hvis man da tenker at c.a 50% av kyllingene inntar 10 eller mer oocyster så kan 50000 vaksinerte fugler produsere 1 milliard oocyster i et produksjonsanlegg.
.jpg?width=455&name=img_2256%20(1).jpg)
Strategien bak vaksinasjons programmene som blir brukt utenfor Norge er litt annerledes enn den strategien som det er blitt lagt opp til her. Vaksinene er først og fremst utviklet for å brukes ilag med koksidiostatika! Det som vanligvis skjer er at koksidier opparbeider seg resistens mot koksidiostatika (som narasin), vaksinen består av svekkede eller usvekkede vaksinestammer som ikke er resistente. Når man gjenintroduserer disse ikke resistente parsitt-stammene og de utkonkurrerer resistente parasitt-stammer som finnes i huset fra før kan man ta i bruk stoffer som narasin igjen, med samme virkning som tidligere. Man kjører altså vaksiner og koksidiostatika i sykluser, det har aldri vært planen bak vaksinasjon i Norge. Det som kan være fordelen med vaksinen er at de ikke resistente koksidiene som finnes i vaksinen er mer infeksiøse enn de som finnes i husene fra før, det som skjer er at vaksine parasittene stimulerer en tidlig immunreaksjon hos fuglen i tillegg til at den utkonkurrerer andre parasitter hvis den får gjennomført sin livssyklus. Paradokset her er at i Norge så fjerner vi strø og desinfiserer mellom hvert innsett, om vaksineparasittene skal etablere seg i et hus og utkonkurrere andre mer skadelige stammer så hjelper det ikke så mye om man fjerner det som er nødvendig for at den skal fullføre sin livssyklus. Man påfører altså fuglen stress i form av en immunreaksjon som i beste fall ikke er nødvendig, om parasittene ikke finnes i huset fra før.
Hva skjer i praksis? Om man skulle ha et koksidie utbrudd i huset og man har vaksinert fuglene sine eller eventuelt ikke har vaksinert fuglene? Vi testet vaksinen i en tidlig fase for å forstå mer om nytten i praksis.
.png?width=455&name=figur-1%20(2).png)
Figur 1. Eimeria spp. OPG i strø.
Vaksinen ble sprayet direkte på startfôret til kontroll leddet rett før kyllingen ble satt ut i huset. Dette for å sikre at kyllingen skulle få i seg en levende vaksine. Strø prøver ble samlet inn på dag 25, 28 og 31 og sendt inn til analyse for å følge med på utviklingen i den kritiske perioden. Man fant igjen lave nivåer av Eimeria spp. på test leddet, men på nivåer som ikke anses høye nok til å kunne forårsake et utbrudd av koksidiose. I kontroll leddet hvor man ikke hadde gitt vaksine fant man på dag 25 ikke parasitt men utover innsette på dag 28 og 31 observerte man mange flere parasitter.
.png?width=455&name=figur-2%20(2).png)
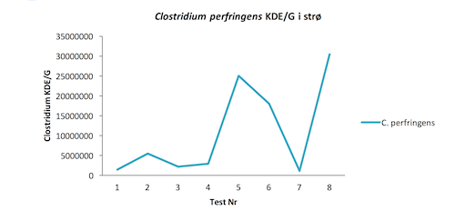
Figur 2. Clostridium perfringens KDE/G i strø
Prøver for tarmbakterien Clostridium perfringens i strø ble også sendt inn for analyse. Det ble observert en drastisk økning bakterier utover innsette på kontroll leddet. På bakgrunn av Hofshagen og Kaldhusdal (1992) sitt tallmateriale kan man bruke antall C.perfringens i avføring og strø som en nyttig indikator på risiko for NE i den flokken eller gruppen prøvene er tatt fra. Bakterietall større eller lik ti millioner per gram samleprøve kan tyde på stor sannsynlighet for sykdom. På Dag 31 ser vi tall opp mot 80 millioner og vi bør derfor kunne anta at man har et sykdomsbilde.
|
Test
|
Alder (d)
|
Slaktevekt (g)
|
Tilvekst
|
Fôrfaktor
|
|
Kontroll
|
32
|
1186
|
37,1
|
2,08
|
|
Vaksine
|
32
|
1174
|
36,7
|
2,10
|
Figur 3. Produksjonstall fra vaksine forsøk
Produksjonsdata fra samme innsett viser derfor noe oppsiktsvekkende at de høye bakterie og parasitt tallene tilsynelatende ikke har noen effekt på produksjonen. Tilnærmet lik tilvekst og fôrforbruk! Man skulle kunne forvente at fugler med sykdom eller sub-klinisk sykdom ville har høyere fôrforbruk og lavere tilvekst. Det som er viktig å ta med i betraktningen er at de høye tallene er observert helt på slutten av innsette på dag 31. Fuglene ble slaktet på dag 32, om fuglene hadde fått leve frem til dag 45 er det mulig at hadde utviklet seg et sykdomsbilde.
HYGIENE, VASK OG VALG AV DESINFEKSJONSMIDDEL
Hygiene og vask spiller en stor rolle i alle programmer for å kontrollere sykdomsutbrudd, dette gjelder også kylling produksjon. «Alt inn/Alt ut» metoden er viktig del av denne produksjonen og tanken er at man på denne måten kan ha mer kontroll på sykdomsutbrudd. Da er man avhengig av at produksjonsanlegget blir metodisk forberedt på neste innsett. Fjerning av fugler, strø, tørr og bløt utvask, samt desinfeksjon av området er kritisk for å sikre at man får et godt utgangspunkt for neste innsett (Meroz og Samberg, 1995). Særlig etter at man har fjernet narasin fra fôret er denne delen av produksjonen blitt mer betydningsfull en tidligere. Narasin har vært forsvarsmiddel nummer 1 mot parasitter men har også hatt en antibakteriell effekt og vært særlig effektiv på den andre store problemskaperen C. perfringens. Når man nå skal fortsette med produksjon uten koksidiostatika i fôret er det enda viktigere at det er fokus på hygiene i alle ledd av produksjonen – dette er nøkkelen for å få det til.
Clostridium perfringens er en sporedannende gram positive bakterie. Den overalt finnes i jord samt i tarmen på de fleste dyr. Den trivs godt i temperaturer mellom 10 og 50 grader og i pH mellom 5-8. Dyr som kylling er den perfekte verten for denne bakterien, og ettersom kyllingen er i konstant kontakt med sin egen og andre fuglers avføring kan bakteriens sporer enkelt overføres fra individ til individ. Bakterien kan i verstefall forårsake nekrotiserende enteritt. Dette er en anaerob bakterie, det vil si at den vokser uten tilgang til oksygen, men sporene den produserer tåler oksygen. Sporene er ekstremt robuste og tåler godt høye temperaturer, det er veldig vanskelig å bli kvitt sporene ved vanlig vask selv med høy temperatur.
Figur 4. Utvikling av gjennomsnitt C. perfringens tall i strø gjennom 8 narasinfrie tester
I våre forsøk har vi observert at tallet på clostridier kan varier veldig men vi ser likevel en stigende trend, det er mer bakterier i huset etter 8 runder med narasinfrie forsøk enn det var etter 1 runde. Forskjellige faktorer har bidratt til varierende resultater her, så det er vanskelig å konkludere hvorfor bakterietallet endrer seg såpass mye fra innsett til innsett. Det vi vet er at livssyklusen til både koksidier og clostridier innebærer produksjon av sporer som er svært vanskelige å ta knekken på, det bør derfor brukes såper eller desinfeksjonsmiddel som faktisk har bevist effekt mot nettopp sporer.
Neopredisan er et slikt desinfeksjonsmiddel. Virkestoffet I Neopredisan er 4-chloro-3-methyl-phenol eller chlorocresol (MAK, 1991). Det er en klorinert phenol eller halophenol. Det blir brukt i mange typer desinfiseringsmidler men virkningsmekanismen er lite studert, ettersom det er en phenol kan man forvente at det har en effekt på mikrobielle membraner. Phenoler induserer lekasje gjennom cellemembranet (McDonnel and Russel, 1999). Forsøk har vist at 4% neopredisan utblandet i væske gir 95,2% til 96,8% inaktiverte Eimeria oocyster etter 120 minutt med behandling (Daugschies et al., 2002).

Forskjellige mikroorganismer varierer i sin respons mot antibakterielle stoffer og desinfiseringsmidler, ikke så overraskende gitt at det er veldig stor forskjell I deres cellestruktur, komposisjon og fysiologi. For at et desinfeksjonsmolekyl skal nå sitt mål må det krysse de ytre lagene i cellen. Medfødt resistens mot inntrengende molekyler er derfor en naturlig egenskap som gjør den bakterielle cellen i stand til å overleve. Clostridie bakterier er noen av de mest studerte og dessverre mest motstandsdyktige mot desinfeksjonsmiddel. Resistens er i dette tilfellet feil begrep og man burde heller snakke om toleranse. Mikroorganismene har et forsvar som gjør at den tolerer å overleve i nærvær et aktivt middel, det betyr ikke at den er resistent.
Den resistensen man bør være bekymret for er den tilegnede resistensen som kan forekomme ved overførsel av plasmider mellom bakterier, eller gjennom mutasjon i bakteriens kromosomer. I forsøk har man vist at noen bakterier kan bli resistente mot noen desinfeksjonsmidler pga. mutasjoner. Det er en hvis bekymring knyttet opp mot bruken av desinfeksjonsmidler som Neopredisan fordi man er redd for at slike situasjoner kan oppstå. Dessverre så vet man ikke sikkert om såper og desinfeksjonsmidler kan gi tilegnet resistens, det er svært lite forskning på dette området og resultatene er sprikenede og spekulative (McDonnell and Russel, 1999). Ofte er dårlig virkning knyttet opp mot feil bruk av desinfeksjonsmiddel, for eks. feil konsentrasjon, utriktig applikasjon, eller dårlige rutiner knyttet opp mot hygiene (McDonnell and Russel, 1999). Når det gjelder såper og desinfeksjonsmidler så foreligger det for lite tall, spesielt knyttet opp mot spesifikke produkter til å kunne si at det er en fare ved bruk av desinfeksjonsmidler. I sin tiltaksveileder for forebygging og tiltak ved mage-tarmsjukdom hos slaktekylling anbefaler Animalia at man bruker Neopredisan to ganger i året og etter problem innsett. Når man skal velge desinfeksjonsmiddel er det viktig å bruke midler som har dokumentert effekt mot sporer, produkter som Neopredisan kan være et nøkkel redskap i kampen om å opprettholde en effektiv produksjon med frisk kylling!
KILDER
Daugschies, A. Bose, R. Marx, J. teach, K. Friedhoff, K.T. 2002. Development and application of a standardized assay for chemical disinfection og coccida oocysts. Veterinary Parasitology 103(4) pp. 299-308.
Chapman, H.D. and Jeffers, T.K. 2014. Vaccination of chickens against coccidiosis ameliorates drug resistance in commercial poultry production.International Journal for Parasitology: Drugs and Drug Resistance 2014 Dec; 4(3): 214–217.
Hofshagen, M og Kaldhusdal, M. Sammenheng mellom antall bakterier i avføring og nekrotiserende enteritt hos slaktekylling.
MAK Value Documentation, 1991. p-Chloro-m-cresol The MAK Collection for Occupational Health and Safety. 272–282.
McDonnell, G and Russell, A.D. 1999. Antiseptices and Disinfectants: Activity, Action and Resistance. Clinical microbiology Reviews 12(1) pp 147 – 179.
Meroz, M and Samberg, Y. 1995. Disinfecting poultry production premises. Scientific and Technical Review of the Office International des Epizooties 14(2) pp. 273-291

.jpg?width=455&name=img_2256%20(1).jpg)
.png?width=455&name=figur-1%20(2).png)
.png?width=455&name=figur-2%20(2).png)









